
美國食品藥品監督管理局(FDA)早在今年(2020年)2月初就為了應對各類醫療器械的緊缺發布了各類EUA緊急使用授權,隨后在今年的3月2日及27日又發行了個人防護設備的EUA。

包括:
呼吸機EUA
個人防護裝備EUA
體外診斷EUA
原文鏈接:
https://www.fda.gov/medical-devices/emergency-situations-medical-devices/emergency-use-authorizations
其中個人防護設備EUA解讀
01.發布時間及適用產品
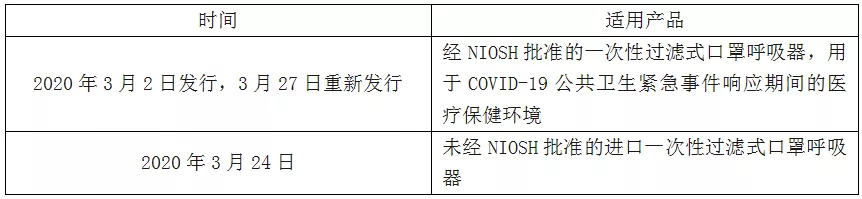
02.注意事項
EUA授權的口罩均不能用于個人,只能是醫護人員

03.EUA申請流程
①:遞交申請(附相關資料)
②:FDA根據產品類型提交需要注冊的資料清單
③:企業按要求遞交相關資料
④:FDA對其進行審批
⑤:企業根據要求進行整改
⑥:FDA最終做出決定(其審批時間可能加快至半個月)
04.EUA認可標準和證書
產品面向醫用市場,則產品滿足以下標準或者認證即可:
歐盟CE 認證
澳大利亞ARTG
加拿大Health Canada Licence
日本PMDA/ MHLW
或以下相關標準:
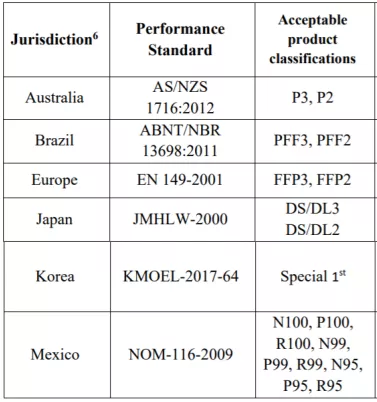
或者直接獲得美國NIOSH認證(限以下三種類型)
1) Non-powered air-purifying particulate FFRs and reusable respirators such as elastomeric half and full face piece respirators, approved by NIOSH in accordance
with 42 CFR Part 84 and listed on the NIOSH Certified Equipment list (CEL) for non-powered air purifying respirators with particulate protection;
2) Other powered air purifying respirators (PAPRs) approved by NIOSH, in accordance with 42 CFR Part 84, and that are listed on the NIOSH CEL for PAPRs
with particulate protection, and;
3) FFRs that were NIOSH-approved but have since passed the manufacturers’ recommended shelf-life, are not damaged, and have been held in accordance with manufacturers’ storage conditions in strategic stockpiles,
for use in healthcare settings by HCPs .
原文鏈接:
https://www.fda.gov/media/136403/download
產品面向個人市場,則產品應獲得NIOSH認證
05.特別注意
CDC優化呼吸器供應策略中推薦的NIOSH替代標準,除了中國標準:GB 2626-2006外,其他均被EUA采納。
這就意味著,中國標準不能用于EUA申請。
即使中國標準口罩被認為可以提供給個人使用,但目前必須再通過NIOSH認證。
原文鏈接:
https://www.cdc.gov/coronavirus/2019-ncov/hcp/respirators-strategy/crisis-alternate-strategies.html